KI enthüllt, dass ein Biomarker für Alzheimer tatsächlich eine Ursache ist

Forscher an der University of California San Diego haben künstliche Intelligenz eingesetzt, um zu zeigen, dass das PHGDH-Gen, das zuvor als Biomarker für Alzheimer identifiziert wurde, tatsächlich eine direkte Ursache der Erkrankung ist – aufgrund einer neu entdeckten sekundären Funktion. Laut der in Cell veröffentlichten und von der UCSD berichteten Studie vertieft dieser Durchbruch nicht nur das Verständnis von spontanem Alzheimer, sondern eröffnet auch den Weg zu gezielten Behandlungen für eine Krankheit, die jeden Neunten über 65 Jahren betrifft.
Sekundäre Funktion des PHGDH-Gens
Über seine bekannte Rolle bei der Produktion des für die Serinsynthese essenziellen Enzyms hinaus, übernimmt PHGDH eine Nebenfunktion als Regulator der Genexpression in Gehirnzellen – eine zuvor offensichtliche, aber verborgene Funktion. Mithilfe von KI zur Modellierung der dreidimensionalen Struktur des Proteins entdeckten Forscher eine DNA-bindende Unterstruktur, die es PHGDH ermöglicht, spezifische Gene zu aktivieren und so das empfindliche Gleichgewicht der Genaktivität im Gehirn zu stören. Dieses genregulatorische „Unwesen“ – und nicht seine enzymatische Aufgabe – löst eine Kaskade aus, die zu den Frühstadien der Alzheimer-Krankheit führt. Der entscheidende Unterschied zwischen Individuen besteht nicht darin, ob sie PHGDH besitzen, sondern wie viel von diesem Protein produziert wird – höhere Mengen bedeuten mehr Störung und ein stärkeres Fortschreiten der Krankheit1234.
KI-Modellierung der PHGDH-Struktur
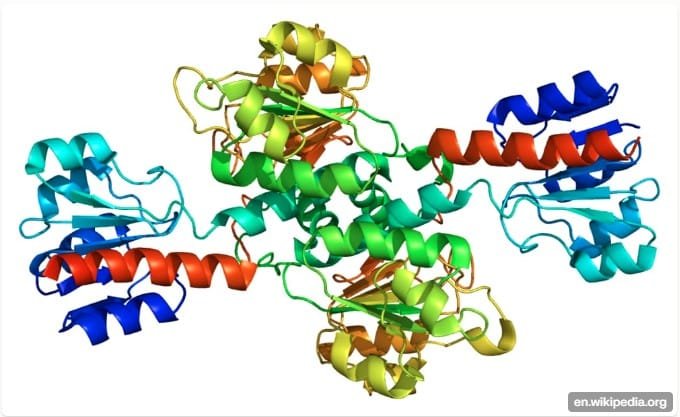
Künstliche Intelligenz war der heimliche Held bei dieser Entdeckung und agierte sowohl als molekularer Kartograf als auch als Detektiv. Durch die Vorhersage der dreidimensionalen Struktur von PHGDH mit bemerkenswerter Präzision enthüllten KI-Tools eine verborgene Substruktur – eine DNA-Bindedomäne –, die bei einer herkömmlichen Proteinsequenzanalyse völlig übersehen worden wäre. Dieser strukturelle Doppelgänger bekannter Transkriptionsfaktoren verlieh PHGDH seine unerwartete genregulierende Kraft und erklärte seinen störenden Einfluss bei Alzheimer. Das KI-gesteuerte Modellieren beschränkte sich nicht nur auf die Visualisierung: Es ermöglichte Forschern, zu simulieren, wie kleine Moleküle die abtrünnige regulatorische Aktivität von PHGDH blockieren könnten, und beschleunigte so die Suche nach therapeutischen Kandidaten wie NCT-503, die gezielt nur die problematische Funktion angreifen und die essenzielle enzymatische Rolle verschonen1234.
NCT-503 als therapeutischer Kandidat
NCT-503 hat sich als herausragendes kleines Molekül in der Suche nach einer Möglichkeit herausgestellt, das genregulierende Unwesen von PHGDH zu zügeln, ohne seine lebenswichtige enzymatische Rolle in der Serinproduktion zu sabotieren. Besonders attraktiv macht NCT-503 seine Fähigkeit, die Blut-Hirn-Schranke zu überwinden und selektiv die regulatorische Funktion von PHGDH zu hemmen, während die Serinsynthese weitgehend unberührt bleibt – ein entscheidender Unterschied für die Gehirngesundheit123. In Mausmodellen mit Alzheimer-assoziierten Mutationen führte die Behandlung mit NCT-503 zu einer Reihe ermutigender Ergebnisse: verringerter Aufbau von Amyloid-Plaques, verbesserte Gedächtnisleistung und reduzierte angstähnliche Verhaltensweisen – und das alles, ohne die Serinspiegel im Gehirn zu verändern4215.
Das Potenzial der Verbindung geht über die Linderung von Symptomen hinaus. Durch die gezielte Hemmung von PHGDH „stromaufwärts“ der Amyloid-Plaque-Bildung deutet NCT-503 auf die verlockende Möglichkeit hin, das Fortschreiten der Krankheit früher als mit aktuellen Therapien aufzuhalten. Auch wenn der Sprung vom Mausmodell zum Menschen eine große Herausforderung bleibt – Tiermodelle können Alzheimer nicht vollständig nachahmen – positionieren diese Ergebnisse NCT-503 als einen führenden Kandidaten für die weitere klinische Entwicklung und als ein herausragendes Beispiel dafür, wie KI-gestützte Arzneimittelentwicklung die Suche nach neuen Alzheimer-Therapien beschleunigt153.









